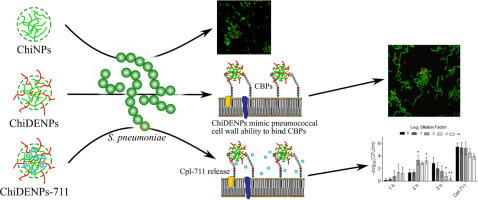
El desarrollo de nuevos biomateriales avanzados nos proporcionan nuevas vias para implementar estrategias más efectivas en la lucha contra las infecciones bacterianas. Dentro de este campo uno de los biopolímeros mas utilizados es el quitosano. En el presente artículo derivatizamos nanoparticulas de quitosano con grupos dietilaminoetilo (ChiDENP) con el objetivo de simular los grupos colina presentes en la pared celular neumocócica y de esta forma actuar como ligandos para las proteinas de unión a colina (CBP). En primer lugar hemos evaluado la capacidad del dietilaminoetilo (DEAE) para secuestrar las CBP de la superficie bacteriana. A la vista de los buenos resultados se ha propuesto la encapsulación de la enzima antimicrobiana CPL-711 dentro de las ChiDENP. Estas particulas presentan una buena estabilidad y un perfil de liberación adecuado para el tratamiento antimicrobiano, proporcionando una plataforma prometedora para la liberación controlada de enzimáticos CBP en contextos biológicos.
Nanopartículas poliméricas cargadas con paclitaxel basadas en el succinato de α-tocoferilo para el tratamiento de carcinoma de células escamosas de cabeza y cuello: modelo in vivo murino
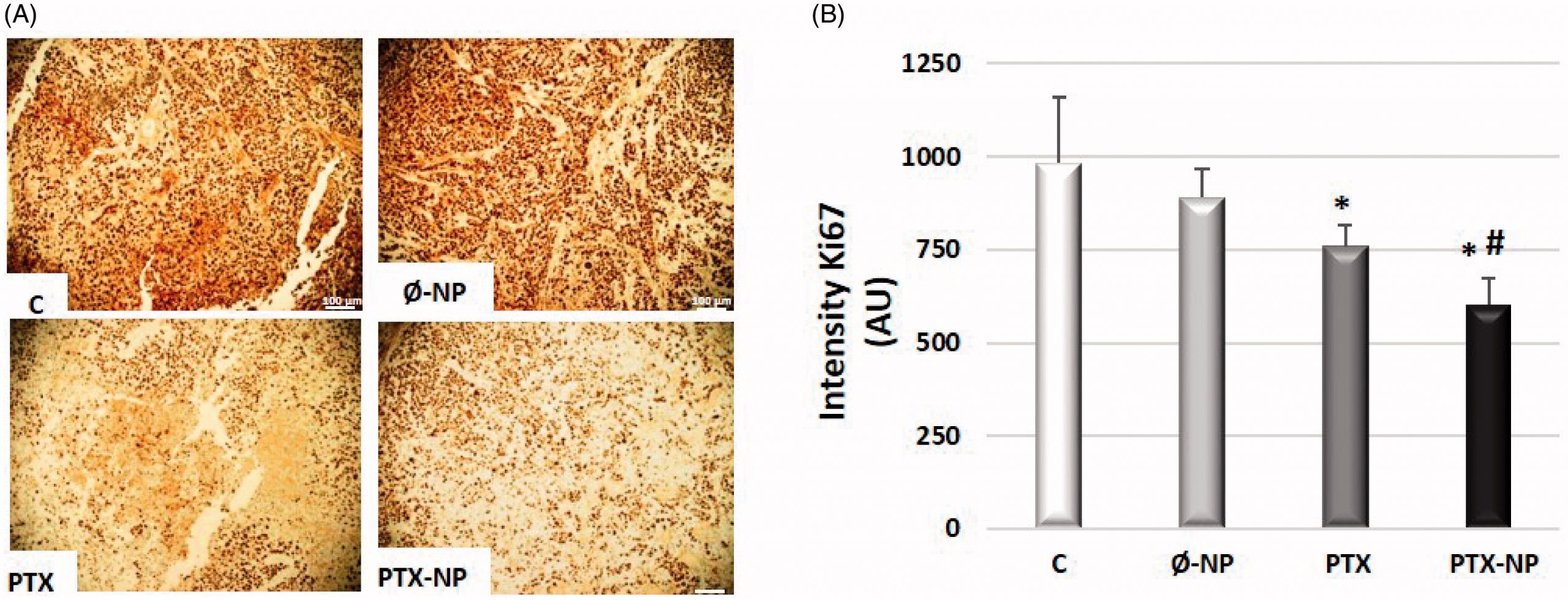
El pronóstico de los pacientes con cáncer de células escamosas de cabeza y cuello recurrente o metastásico (HNSCC) es generalmente pobre. Se requieren nuevos tratamientos para complementar el estándar de atención actual. En particular, el paclitaxel (PTX), un quimioterapéutico eficaz para el HNSCC, tiene efectos secundarios graves. Por ello, se prepararon un sistema de nanoportadores poliméricos para la administración de PTX con el fin de mejorar el tratamiento de HNSCC. Así pues, este estudio tuvo como objetivo evaluar la eficacia antitumoral de nanopartículas poliméricas cargadas con PTX basadas en α-TOS (PTX-NP) administradas por inyección intratumoral directa en un xenoinjerto de tumor de células escamosas de carcinoma de hipofaringe (FaDu) utilizando un modelo de ratón. Las nanopartículas se prepararon por nanoprecipitación utilizando copolímeros de bloque de polietilenglicol (PEG) y un derivado metacrílico del α-TOS y se cargó eficazmente el PTX en el sistema de administración. El volumen del tumor se midió para evaluar el efecto antitumoral de las PTX-NP. Los mecanismos relativos a procesos de apoptosis, proliferación celular, angiogénesis y estrés oxidativo y nitrosativo se cuantificaron por Western Blott, con sondas fluorescentes y análisis inmunohistoquímico. Los resultados mostraron que, en comparación con la PTX libre, las PTX-NP exhibieron una eficacia antitumoral mucho mayor, induciendo la apoptosis en un modelo de xenoinjerto de ratón FaDu con un perfil de seguridad además mejorado.
La expresión de Ki-67, EGFR y marcadores de angiogénesis (Factor VIII, CD31 y CD34) fue significativa menor en el grupo de PTX-NP en comparación con otros grupos (p <.05). Además, las PTX-NP inducen oxidativo y estrés nitrosativo en el tejido tumoral. Por todo ello, la administración directa de nanopartículas poliméricas cargadas con PTX en el sitio del tumor resultó ser un tratamiento prometedor para la terapia contra el HNSCC.
Nanopartículas cargadas con naproxeno y recubiertas con ácido hialurónico con la capacidad de atacar selectivamente a las células madre cancerígenas a través de vías independientes de COX
Este trabajo es fruto de una colaboración en el marco del CIBER-BBN entre el Grupo de Biomateriales del ICTP-CSIC, el Grupo de Liberación Controlada y Dirigida de la Fundación para la Investigación del Hospital Val d’Hebron y el Grupo de Validación Funcional e Investigación Preclínica de la Universidad Autónoma de Barcelona.
Varios trabajos han demostrado la relación entre la inflamación crónica, la carcinogénesis y la presencia de células madre cancerígenas (CSC, cancer stem cells). En este trabajo estudiamos si el naproxeno, un antiinflamatorio no esteroideo, podría reducir la progresión y diseminación de tumores metastásicos de difícil tratamiento, si se vehiculiza específicamente a las CSC. Para ello se sintetizaron nanopartículas (NPs) catiónicas que incorporaban naproxeno en su estructura y se recubrieron con ácido hialurónico (HA) mediante interacción electrostática. Se realizó una completa caracterización físico-química y biológica de las NPs empleando células cancerígenas, macrófagos y células endoteliales. Nuestros resultados demostraron que el recubrimiento con HA proporciona un mejor control de la liberación del fármaco y mejoraba la hemocompatibilidad de las NPs, además de inducir una mayor acumulación en la subpoblación CSC de células de cáncer de mama MCF-7. Además, las NPs inducen la apoptosis de MCF-7 reduciendo la viabilidad de las células en mayor proporción que la misma concentración de naproxeno libre. Las NPs también reducen la migración celular de las células cancerígenas objeto de estudio. Este incremento de la actividad anticancerígena de las NPs podría estar relacionado con la inducción de la apoptosis mediante alteraciones de la vía GSK-3b COX-independiente.
Todo ello sugiere que las NPs descritas tienen el potencial de mejorar el tratamiento del cáncer de mama avanzado por el aumento del efecto antiproliferativo del naproxeno en la subpoblación CSC.
Modulación de mediadores inflamatorios por nanopartículas poliméricas cargadas con fármacos anti-inflamatorios
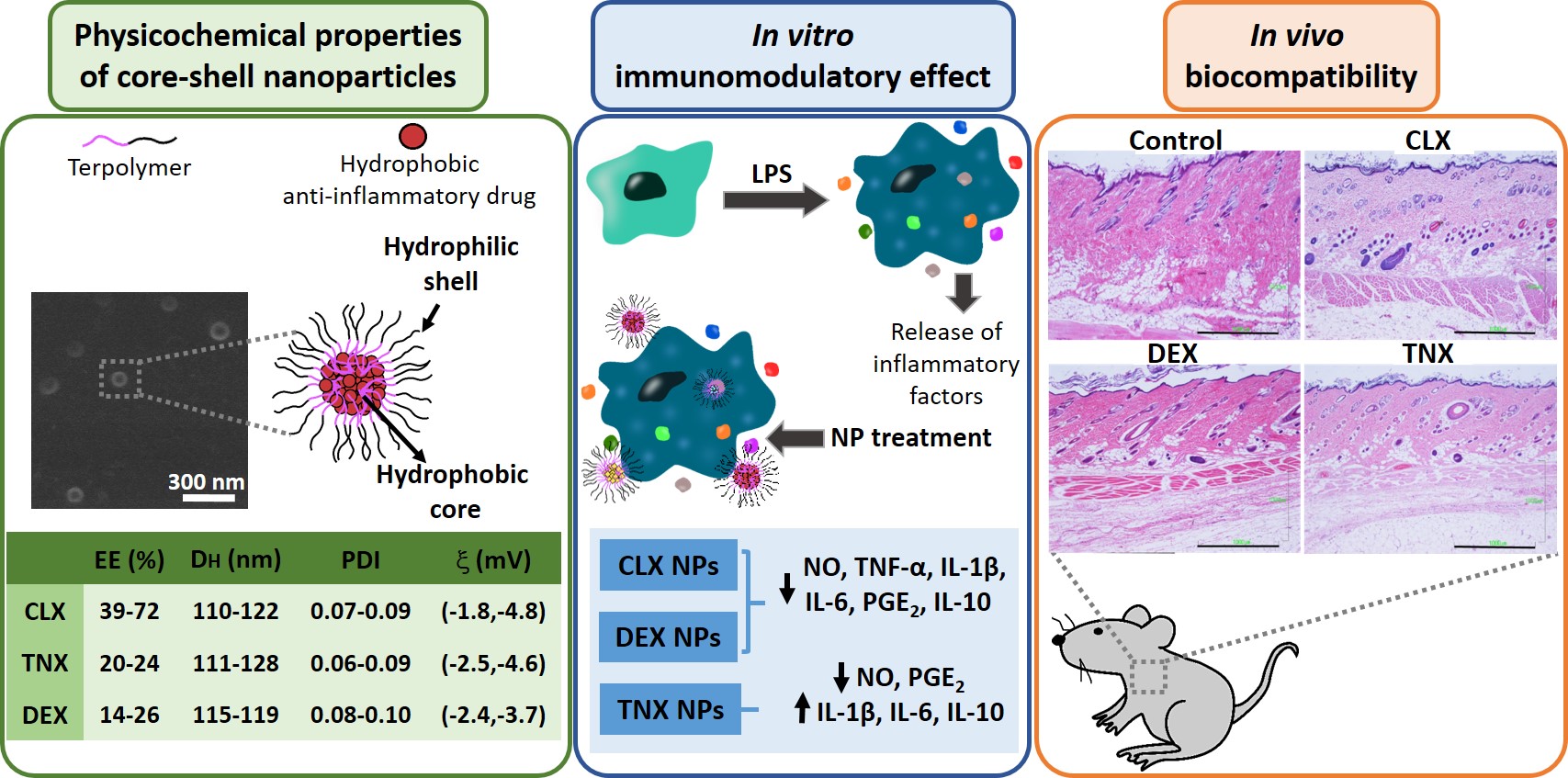
Los tratamientos de primera línea de la osteoartritis se basan en fármacos anti-inflamatorios, siendo los más usados los anti-inflamatorios no esteroideos (AINEs), los inhibidores específicos de COX-2 y los corticoides. La mayoría de ellos presenta citotoxicidad y una baja biodisponibilidad en condiciones fisiológicas, haciendo necesaria la administración de altas concentraciones que provocan diferentes efectos secundarios. El objetivo de este trabajo ha sido encapsular tres anti-inflamatorios hidrofóbicos de diferentes naturalezas (celecoxib, tenoxicam y dexametasona) en nanopartículas poliméricas con potencial aplicación en osteoartritis. Las nanopartículas presentan tamaños entre 110 y 130 nm, con cargas neutras (entre -1 y -5 mV). La eficiencia de encapsulación demostró ser altamente dependiente del fármaco encapsulado y de su solubilidad en agua, obteniendo los mayores valores para el celecoxib (39-72%) seguido del tenoxicam (20-24%) y de la dexametasona (14-26%). La nanoencapsulación redujo la citotoxicidad del celecoxib y la dexametasona en condrocitos articulares humanos y macrófagos murinos RAW264.7. Además, los tres sistemas cargados mostraron ser no citotóxicos en un amplio rango de concentraciones. Las nanopartículas cargadas con celecoxib y dexametasona redujeron la liberación de diferentes factores inflamatorios (NO, TNF-α, IL-1β, IL-6, PGE2 y IL-10) en RAW264.7 estimulada con LPS. Las nanopartículas cargadas con tenoxicam redujeron la producción de NO y PGE2 , aunque se observó una sobreexpresión de las IL-1β, IL-6 e IL-10. Finalmente, todas las nanopartículas demostraron ser biocompatibles en un modelo de rata mediante inyección subcutánea. Estos descubrimientos sugieren que estas nanopartículas cargadas pueden ser candidatas para el tratamiento de procesos inflamatorios relacionados con la osteoartritis debido a su demostrada actividad in vitro como reguladores de la producción de mediadores inflamatorios.
Nanopartículas poliméricas anfifílicas que encapsulan curcumina: estudios antioxidantes, anti-inflamatorios y de biocompatibilidad
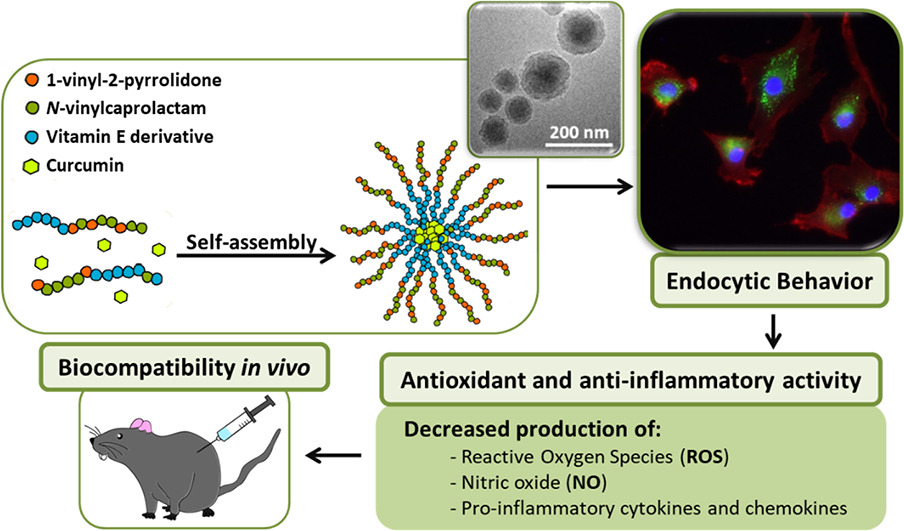
El estrés oxidativo y la inflamación son dos procesos relacionados y comunes a muchas enfermedades. La curcumina es un compuesto natural con propiedades antioxidantes y anti-inflamatorias, entre otras, que se está utilizando recientemente como un producto natural alternativo a los medicamentos tradicionales. Sin embargo, su naturaleza hidrófoba compromete su solubilidad en fluidos fisiológicos y su tiempo de circulación y también presenta problemas de citotoxicidad en su forma libre, limitando el rango de concentraciones a utilizar. Para superar estos inconvenientes y aprovechar los beneficios de la nanotecnología, el objetivo de este trabajo es el desarrollo de nanopartículas poliméricas cargadas con curcumina que puedan proporcionar una liberación controlada del fármaco para su aplicación en el tratamiento de enfermedades relacionadas con el estrés oxidativo y la inflamación. Específicamente, el vehículo es un terpolímero bioactivo basado en un metacrilato del α-tocoferol, 1-vinil-2-pirrolidona y N-vinilcaprolactama. Las nanopartículas se obtuvieron por nanoprecipitación y se caracterizaron en términos de tamaño, morfología, estabilidad, eficiencia de encapsulación y liberación del fármaco. Se realizaron ensayos celulares in vitro en condrocitos articulares humanos y macrófagos RAW 264.7 de ratón, para evaluar la citotoxicidad, la internalización celular y las propiedades antioxidantes y anti-inflamatorias de las nanopartículas. La actividad captadora de radicales de los sistemas se confirmó mediante el ensayo DPPH y la cuantificación de las especies reactivas de oxígeno celulares. El potencial anti-inflamatorio de estos sistemas se demostró mediante la reducción de diferentes factores pro-inflamatorios como las quimioquinas IL-8, MCP y MIP en condrocitos; y el óxido nítrico, IL-6, TNF-α y MCP-1, entre otros, en RAW 264.7. Finalmente, se confirmó la biocompatibilidad in vivo en un modelo de rata inyectando subcutáneamente las nanopartículas. La reducción de la toxicidad de la curcumina libre y las propiedades antioxidantes, antiinflamatorias y de biocompatibilidad abren la puerta a una investigación in vitro e in vivo más profunda sobre estas nanopartículas poliméricas cargadas con curcumina para tratar enfermedades basadas en el estrés oxidativo y la inflamación.
Nanopartículas basadas en copolímeros de 4,7-dicloro-2-quinolinilmetacrilato de metilo con potencial actividad citotóxica hacía células de carcinoma de mama humano
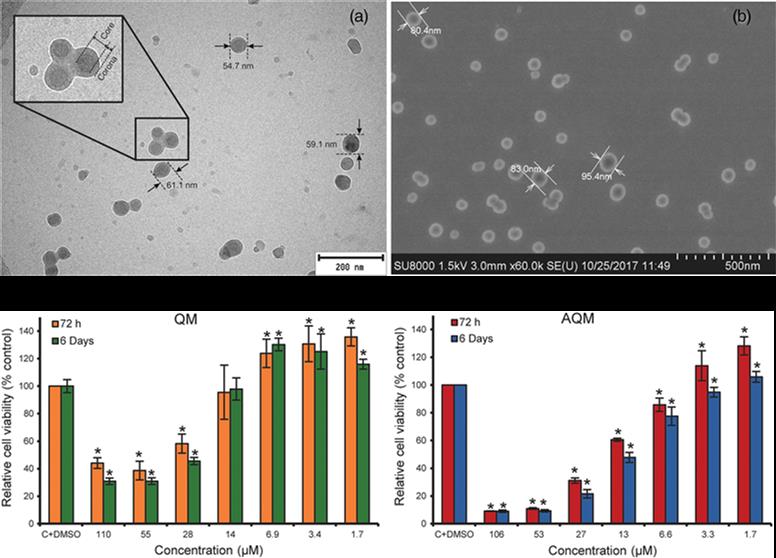
En este artículo, se describe una estrategia optimizada de síntesis del potente compuesto anticancerígeno 4,7-dicloro-2-quinolinometanol (QM) y su éster acrilato 4,7-dicloro-2-quinolinilacrilato de metilo (AQM). AQM se copolimeriza utilizando polimerización por radicales libres con N-vinil-2-pirrolidona (VP). Los copolímeros preparados con diferentes proporciones molares de los comonómeros en la alimentación se someten a nanoprecipitación para obtener suspensiones de nanopartículas (NP) en solución salina tamponada con fosfato (PBS). Las NP más pequeñas y estables se obtienen con los copolímeros AQM-VP 45:55 y 40:60 (118.9 y 128.7 nm de diámetro, respectivamente) a 1 mg/mL, y junto con el AQM y QM, se evalúa su actividad citotóxica en células de carcinoma de mama MDA-MB-453 mediante un ensayo in vitro de MTT. Así pues, el AQM y QM resultan altamente citotóxicos (IC50: 19 y 41 µM, respectivamente); sin embargo, las NP no son citotóxicas en el rango de concentraciones ensayadas. Estos resultados contribuyen a la búsqueda de nuevas NP poliméricas con aplicaciones potenciales como sistemas de liberación de QM para el tratamiento de cáncer u otras enfermedades tratables con QM.
1.Valle, H. et al. Nanoparticles of 4,7-dichloro-2-quinolinemethylacrylate-based copolymers and their potential cytotoxic activity on human breast carcinoma cells. Journal of Applied Polymer Science 136, 47545 (2019). Cite
Nanopartículas poliméricas sensibles al pH con propiedades antiinflamatorias y antioxidantes para proteger el efecto ototóxico del cisplatino
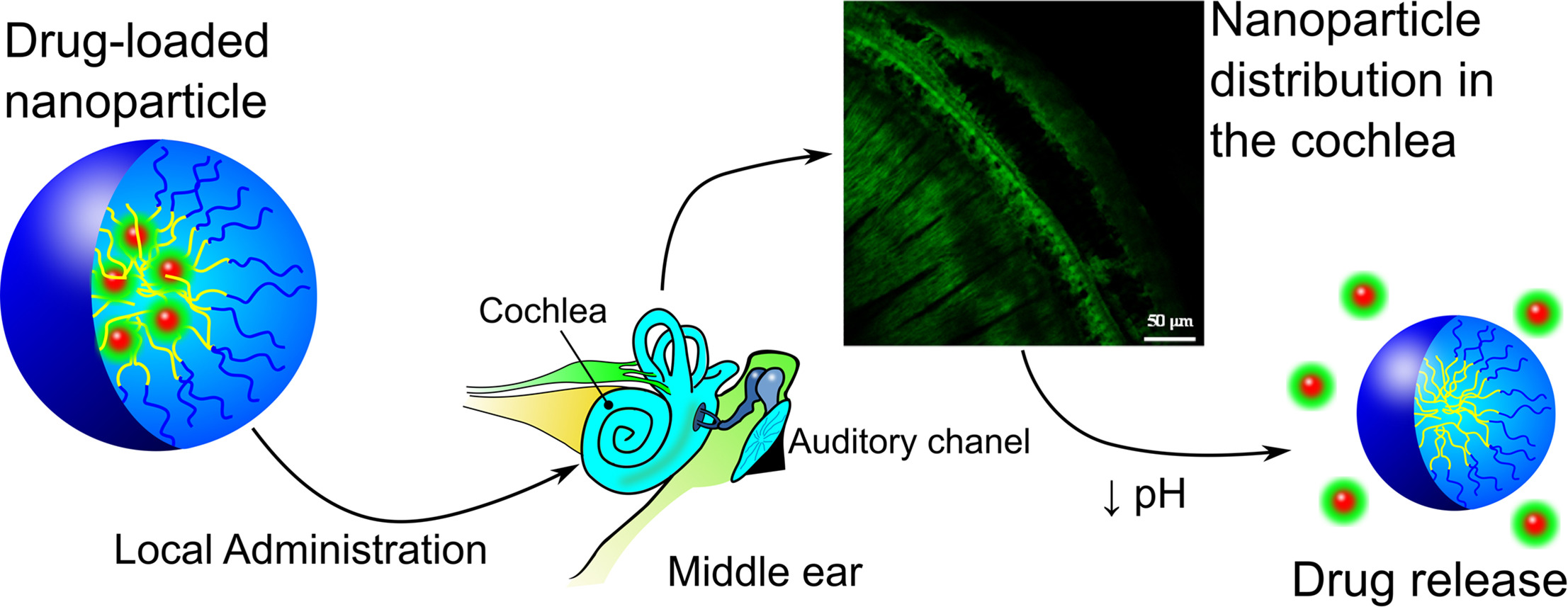
Nanopartículas poliméricas (NP) basadas en copolímeros anfifílicos inteligentes se utilizaron para transportar y liberar de forma controlada dexametasona en el oído interno con el objetivo de proteger contra el efecto ototóxico del cisplatino.
Las NP se basaron en una mezcla de dos fármacos poliméricos de tipo pseudo-bloque obtenidos por polimerización de radicales libres: poli (VI-co-HEI) y poli (VP-co-MVE) o poli (VP-co-MTOS), siendo VI 1-vinilimidazol, VP N-vinilpirrolidona e IBU, MVE y MTOS, los derivados metacrílicos de ibuprofeno, α-tocoferol y succinato de α-tocoferilo, respectivamente.
Las NP se obtuvieron por nanoprecipitación con propiedades hidrodinámicas apropiadas y puntos isoeléctricos que coincidían con el pH del tejido inflamado. Las NP se probaron tanto in vitro (usando células HEI-OC1) como in vivo (usando un modelo murino) con excelentes resultados. Aunque la concentración de dexametasona administrada en las NP es aproximadamente dos órdenes de magnitud menor que el tratamiento convencional para la administración intratimpánica, las NP protegieron del efecto citotóxico de cisplatino cuando la combinación de las propiedades apropiadas en términos de tamaño, potencial zeta, eficiencia de encapsulación y punto isoeléctrico se lograron con éxito. Así pues, esta es la primera vez que se utilizan NP sensibles al pH para proteger la pérdida de audición inducida por cisplatino mediante su administración intratimpánica.
Actividad fototérmica y fotodinámica de nanopartículas poliméricas obtenidas a partir de copolímeros de bloque RAFT conjugados a la sonda IR-780
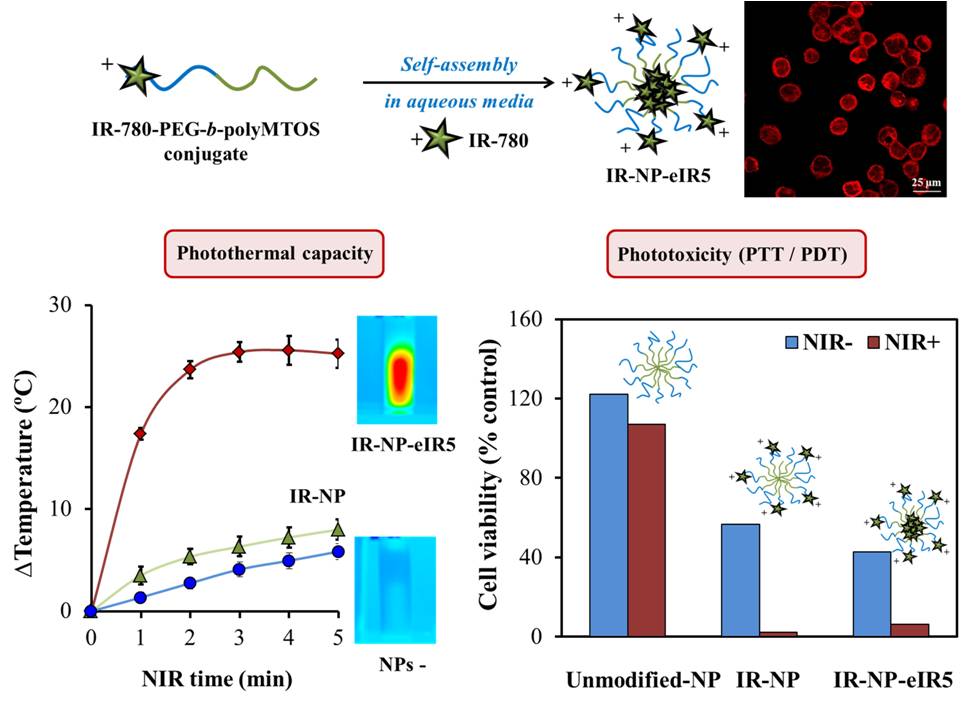
El objetivo de este trabajo fue la preparación de un sistema nanoparticulado multifuncional que incorpora el colorante IR-780, una sonda de imagen infrarroja cercana (NIR) que presenta propiedades fototérmicas y fotodinámicas; y un derivado del succinato de α-tocoferilo (α-TOS), un compuesto anticancerígeno con acción selectiva en las mitocondrias de células tumorales. La sonda IR-780 se conjugó con el segmento hidrófilo del copolímero PEG-b-poliMTOS, sintetizado a partir de poli(etilenglicol) (PEG) y un derivado metacrílico del α-TOS (MTOS), para generar nanopartículas autoensambladas en medio acuoso con una corteza hidrofílica y un nucleo hidrofóbico, denominadas IR-NP. Durante el proceso de autoensamblado, el núcleo de IR-NP permitió encapsular IR-780 adicional para generar nanopartículas con diferente concentración de este colorante (IR-NP-eIR).
La evaluación in vitro de las propiedades fototerapeúticas de IR-NP e IR-NP-eIR se llevó a cabo minuciosamente. Así pues, las partículas desarrolladas mostraron una fluorescencia y un comportamiento fototérmico distintos después de la excitación por una luz láser que emitía a 808 nm. El tratamiento de las células MDA-MB-453 con IR-NP o IR-NP-eIR dio como resultado una internalización eficiente del colorante IR-780, mientras que la posterior irradiación con láser NIR condujo a una disminución severa en la viabilidad celular. La fototoxicidad conducida por IR-NP, que no pudo atribuirse a la generación de una hipertermia letal, produjo un aumento en los niveles de especies de oxígeno reactivo intracelular (ROS). Por lo tanto, la imagen de fluorescencia y la fototoxicidad inducida por las nanopartículas derivadas del copolímero IR-780-PEG-b-poliMTOS confieren un alto valor a estas herramientas nanoterapeúticas en la investigación clínica del cáncer.
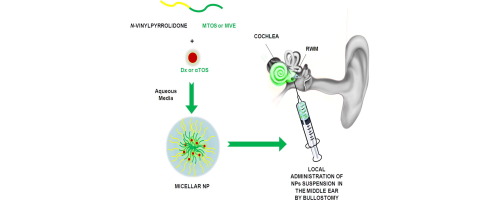
Nanopartículas poliméricas cargadas con dexametasona o succinato de α-tocoferilo para prevenir la ototoxicidad inducida por el cisplatino
El objetivo de este trabajo es el desarrollo de nanopartículas poliméricas que, administradas localmente en el oído medio, palien la ototoxicidad inducida por cisplatino que afecta al 100% de los pacientes clínicos a concentraciones muy altas (16 mg / kg). Estas nanopartículas poliméricas están cargadas con dexametasona o succinato de α-tocoferilo como fármacos anti-inflamatorios y anti-apoptóticos, respectivamente.
Ambas moléculas son muy poco solubles en agua, presentando además efectos secundarios graves cuando se administran sistémicamente durante largos períodos de tiempo. Su incorporación en el núcleo hidrofóbico de nanopartículas con las propiedades hidrodinámicas adecuadas proporciona los efectos deseados in vitro (menor toxicidad inducida por cisplatino, disminución de la actividad de la caspasa 3/7 y menor liberación de IL-1b) e in vivo (reducción de la pérdida auditiva a nivel local).
La administración local de las nanopartículas por bullostomía proporciona una dosis adecuada de fármaco sin interferencia sistémica con el efecto quimioterapéutico del cisplatino.